Niedokrwistość to jeden z najczęstszych problemów medycznych. Sugeruje się, że anemia może dotyczyć nawet 20-35% kobiet w wieku rozrodczym. Co więcej, opierając się na badaniach populacyjnych przeprowadzonych w USA, nawet u 1/3 kobiet w okresie reprodukcyjnym może występować niedobór żelaza zapasowego i aż u 10% z nich niedokrwistość z niedoboru żelaza. Nieleczona anemia może prowadzić do poważnych zaburzeń w funkcjonowaniu organizmu, dlatego trzeba podkreślić, że jej oznaką nie jest wyłącznie bladość skóry. Jak zatem zachować się kiedy podejrzewamy niedokrwistość? Na jakie badania warto się zdecydować i jak wygląda diagnostyka laboratoryjna anemii?
Oczywiście sam fakt występowania niedokrwistości oraz rodzaj anemii mocno wiąże się z regionem geograficznym, stanem socjalnym, płcią, wiekiem oraz współwystępowaniem innych chorób. Choć problem dotyczy obu płci, to kobiety są bardziej predysponowane do rozwoju anemii.
Ze względu na objawy, anemia bywa mylona ze spadkiem odporności.
Czym jest anemia?
Niedokrwistość, czyli anemię definiuje się jako zmniejszenie poziomu hemoglobiny i/lub liczby erytrocytów czy też hematokrytu poniżej wartości referencyjnych w danej populacji (prawidłowe zakresy mogą różnić się np. dla Polaków i Afroamerykanów) w zależności od płci czy wieku. Problem stanowi tutaj nie tyle zmniejszony poziom czerwonych krwinek czy hemoglobiny, lecz dysproporcja związana z zapotrzebowaniem organizmu na tlen a możliwościami dostarczenia go za pośrednictwem erytrocytów.
To zaburzenie wiąże się z niedomaganiem procesów produkcji czerwonych krwinek, wzrostem zapotrzebowania lub zaburzeniem wykorzystania. W konsekwencji dochodzi do pojawienia się szeregu objawów klinicznych, które jednak bardzo często są nieswoiste, a podstawą rozpoznania anemii jest diagnostyka laboratoryjna.
Podział niedokrwistości w oparciu o MCV
Bardzo pomocnym parametrem morfologii krwi obwodowej jest średnia objętość krwinki czerwonej (MCV). Bazując na tym parametrze anemię dzieli się właśnie w oparciu o MCV:
1. Anemia mikrocytarna (MCV < 83 fl), której przyczyną może być:
- niedobór żelaza (najczęstsza przyczyna wszystkich anemii)
- niedokrwistość syderoblastyczna
- talasemie
- niedokrwistość wynikająca z toczących się chorób przewlekłych
- zatrucie ołowiem
2. Anemia normocytarna (MCV w granicach wartości referencyjnych) – dzieli się na:
- związaną z pierwotnym uszkodzeniem szpiku:
– niedokrwistość aplastyczna
– osteomielofibroza
– zespół Blakfana – Diamonda - związaną z wtórnym uszkodzeniem szpiku:
– uremia
– zaburzenia endokrynologiczne
– niedokrwistość chorób przewlekłych
3. Anemia makrocytarna (MCV > 103 fl), która może być kwalifikowana jako:
- niedokrwistości megaloblastyczne, związane z:
– niedoborem witaminy B12
– niedoborem kwasu foliowego
– niedokrwistością polekową
– zespołami mielodysplastycznymi - niedokrwistości niemegaloblastyczne, których przyczyną najczęściej są:
– choroby wątroby
– niedoczynność tarczycy
W praktyce bardzo często bazuje się także na oznaczeniu liczby retikulocytów, co odpowiada aktywności szpiku w kontekście wytwarzania czerwonych krwinek. Dzięki temu możliwe jest podzielenie niedokrwistości na takie, które przebiegają ze zmniejszoną lub zwiększoną syntezą erytrocytów.
To jednak tylko jeden z wielu możliwych podziałów anemii.
Podział anemii w oparciu o jej przyczynę
Kolejną alternatywą może być podział opierający się o przyczynę niedokrwistości, gdzie wyróżnia się m.in.:
- anemię pokrwotoczną – jej przyczyną jest znaczna utrata krwi; typową dla niej jest przewlekła utrata krwi towarzysząca m.in. krwawieniu z przewodu pokarmowego,
- anemię z niedoboru żelaza, stanowiąca najczęściej rozpoznawaną niedokrwistość,
- anemię syderoblastyczną – związaną z zaburzeniami produkcji hemu,
- niedokrwistość chorób przewlekłych, która może być związana z różnymi innymi schorzeniami np. przewlekłymi zakażeniami bakteryjnymi, pasożytniczymi czy grzybiczymi, nowotworami, chorobami autoimmunologicznymi, przewlekłymi zakażeniami dróg moczowych oraz chorobami tarczycy i wątroby,
- niedokrwistość megaloblastyczną – jej przyczyną może być niedobór witaminy B12 czy kwasu foliowego,
- niedokrwistości hemolityczne – gdy krwinki czerwone ulegają zniszczeniu,
- niedokrwistość aplastyczną, której przyczyną jest niewydolność szpiku.
Więcej o anemii przeczytasz także tutaj: Anemia zmorą kobiet. Sprawdź jak sobie skutecznie pomóc!
Anemia – diagnostyka
Pamiętajmy jednak, że niezależnie od przyczyny czy rodzaju niedokrwistości podstawą diagnostyki są badania laboratoryjne oraz dokładny wywiad lekarski. Powinien on uwzględniać:
- objawy,
- stosowane leki,
- zażywane suplementy diety,
- codzienny sposób odżywiania.
Z tego względu każdy pacjent, który zgłasza osłabienie, zmęczenie, problemy z koncentracją, bladość skóry oraz błon śluzowych czy problemy z bólami i zawrotami głowy, powinien wzbudzić szczególną uwagę każdego lekarza czy farmaceuty.
Podstawą diagnostyki laboratoryjnej niedokrwistości jest jedno z najpopularniejszych badań laboratoryjnych – morfologia krwi obwodowej. Badanie to wykorzystuje się jednak nie tylko na etapie stawiania diagnozy, ale także już podczas leczenia. To doskonały sposób na monitorowanie skuteczności farmakoterapii.
Wśród oznaczeń w ramach morfologii ważne w tym kontekście są parametry czerwonokrwinkowe – głównie ilościowe oznaczenie krwinek czerwonych (RBC), stężenie hemoglobiny (HB) i wynik hematokrytu (HT). Warto wiedzieć, że często zdarza się, iż tylko jeden ze wspomnianych parametrów jest zaburzony. Oprócz tego bardzo istotnym parametrem jest MCV i MCHC, czyli średnie stężenie hemoglobiny w krwince czerwonej.
Pomimo trwającej od wielu lat dyskusji na temat klasyfikacji niedokrwistości, wciąż powszechnie stosuje się kryteria rozpoznawania niedokrwistości ustalone przez WHO w 1968 r. Zgodnie z nimi anemię u kobiet rozpoznaje się przy spadku stężenia hemoglobiny (HB) poniżej 12 g/dl, a u mężczyzn poniżej 13 g/dl, również w populacji geriatrycznej.
Stopień ciężkości niedokrwistości ustala się na podstawie stężenia HB, wyróżniając niedokrwistość:
- łagodną (stopień I): HB = 9,5 – 10,9 g/dl
- umiarkowaną (stopień II): HB = 8,0 – 9,4 g/dl
- ciężką (stopień III): HB = 6,5-7,5 g/dl
- bardzo ciężką (stopień IV), określaną jako zagrażającą życiu, przy stężeniu hemoglobiny poniżej 6,5 g/dl.
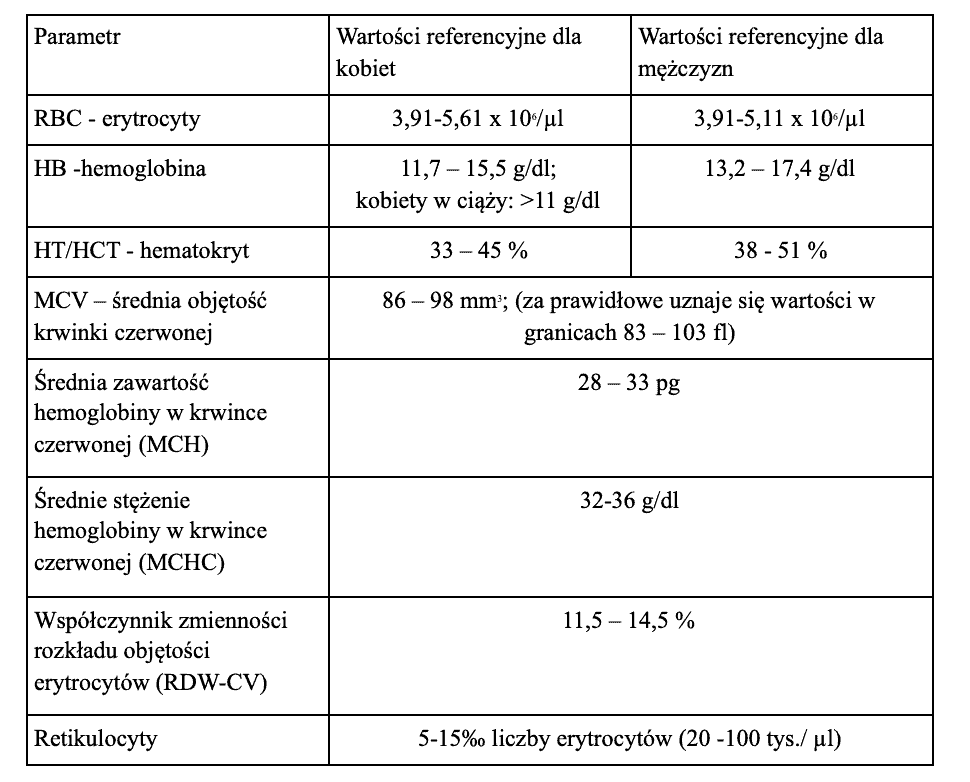
Dla ułatwienia interpretacji wyników podano przykładowe wartości referencyjne morfologii krwi obwodowej opierając się na książce „Diagnostyka laboratoryjna z elementami biochemii klinicznej”. Edra Urban & Partner, 2017.
Sprawdź również: Dlaczego warto regularnie wykonywać badania laboratoryjne?
Anemia – przebieg i objawy
W przypadku bardzo szybko postępujących zmian np. w ostrej hemolizie, po masywnym krwotoku czy w przebiegu ostrych anemii kluczowe jest szybkie wdrożenie leczenia. Dlatego nie zawsze możliwe jest wnikliwe pochylenie się nad diagnostyką. W tak ciężkich przypadkach, niezależnie od tego jaka jest przyczyna anemii, w organizmie dochodzi do niedotlenienia tkanek i organów (tak zwany „głód tlenowy”).
Objawy te mają miejsce zazwyczaj przy HB na poziomie wartości poniżej 7, co wiąże się zazwyczaj ze spadkiem HT o około 25%. Tym niemniej u osoby starszej z niewydolnością krążeniowo-oddechową objawy głodu tlenowego mogą pojawić się już przy HB poniżej 11.
Diagnoza niedokrwistości na podstawie zaburzonych parametrów czerwonokrwinkowych morfologii nie oznacza zazwyczaj końca diagnostyki. Kolejnym krokiem będzie oznaczenie liczby retikulocytów. Poziom wyższy niż 80-85 tys./µl przy obecności niedokrwistości oznacza, że układ krwiotwórczy posiada zdolności regeneracyjne.
Wartości retykulocytów > 150 tys./µl sugerują przyspieszony rozpad (hemolizę) i wtórną zwiększoną odnowę. Z kolei im ich stężenie jest niższe od 80 000/µl, tym bardziej przemawia za zaburzoną produkcją erytrocytów. Przy wartościach liczby retykulocytów poniżej 25 tys./µl mamy do czynienia z głębokim upośledzeniem produkcji krwinek.
Anemia z niedoboru żelaza
Jak wspomniałam wcześniej, najczęściej diagnozowaną niedokrwistością jest anemia z niedoboru żelaza. Kolejnym krokiem w diagnostyce powinno być więc wykonanie oznaczenia poziomu żelaza w surowicy krwi. Oznaczenie to wykonuje się zazwyczaj równolegle z morfologią lub jako badanie uzupełniające, już po otrzymaniu nieprawidłowych wyników morfologii.
To właśnie żelazo (jako kation Fe2+), będące w centrum cząsteczki hemoglobiny, umożliwia przenoszenie tlenu. Wchłania się ono głównie na poziomie dwunastnicy i kolejnych odcinków jelita cienkiego. W błonie śluzowej przewodu pokarmowego wiąże się z apoferrytyną, na skutek czego powstaje ferrytyna (a żelazo Fe3+). Również w postaci ferrytyny żelazo jest magazynowane w wątrobie. Transport żelaza we krwi z kolei odbywa się za pośrednictwem transferryny.
Samo badanie poziomu żelaza nie wymaga specjalnego przygotowania – pacjent nie musi być na czczo. Zaleca się jednak zadbanie o dobre nawodnienie przed badaniem. Prawidłowe wyniki mieszczą się w zakresie 11–33 µmol/l (60–80 µg/dl).
Pamiętajmy jednak, że sam wynik oznaczenia żelaza (nawet prawidłowy!) nie zawsze jest miarodajny – może nie wskazać jednoznacznej przyczyny niedokrwistości. Również przy podejrzeniu anemii z niedoboru żelaza niekiedy wyniki oznaczeń samego żelaza mogą jeszcze znajdować się w granicach wartości referencyjnych.
Z tego względu kolejnym krokiem w diagnostyce powinno być tu oznaczenie ferrytyny i transferryny, a także wykonanie oznaczenia TIBC oraz UIBC (całkowita i utajona zdolność wiązania żelaza).
UWAGA: przyczyny anemii z niedoboru żelaza mogą być bardzo różne, począwszy od zwiększonej utraty krwi (np. krwotoki), a skończywszy na znacznie większym zapotrzebowaniu, na przykład w okresie ciąży.
Anemia a kliniczna ocena zapasów żelaza w organizmie
Ferrytyna
Ferrytyna to białko, które pełni funkcję magazynu żelaza w organizmie – jej stężenie odzwierciedla jego zapasy. Znajdziemy ją w dużych ilościach w wątrobie, śledzionie i szpiku kostnym. Ferrytyna stanowi jeden z najlepszych parametrów pozwalających ocenić niedobory żelaza. Spadek jej stężenia odnotowuje się w niedokrwistości z niedoboru żelaza oraz w utajonym niedoborze żelaza.
Wzrost poziomu ferrytyny jest w mniejszym stopniu zależny od stężenia żelaza.
Ferrytyna, jako białko ostrej fazy, wzrasta nieswoiście w stanach zapalnych, podczas infekcji, chorobach nowotworowych i zaburzeniach funkcji wątroby. Podwyższone wartości tego parametru występują w chorobach (uszkodzeniu) wątroby, w hemochromatozie lub nieefektywnej erytropoezie, przedawkowaniu żelaza i po przetoczeniach krwi.
Oznaczenie ferrytyny jest także dobrym sposobem różnicowania anemii z niedoboru żelaza od anemii o innej etiologii, monitorowania leczenia oraz wykrywania zaniku rezerw żelaza w stanie poprzedzającym anemię – także u pacjentów poddawanych dializom.
Przed badaniem należy być na czczo, a same zakresy wartości referencyjnych zależą w dużym stopniu od płci i wieku:
- <1 roku 12,0-327,0 ng/ml
- 1-3 lata 6,0-67,0 ng/ml
- 3-6 lat 4,0-67,0 ng/ml
- 6-12 lat kobiety: 7,0-84,0 ng/ml; mężczyźni: 14,0-124,0 ng/ml
- 12-17 lat kobiety: 13,0-68,0 ng/ml; mężczyźni: 12-17 lat 14,0-152,0 ng/ml
- >17 lat kobiety: 13,0-150,0 ng/ml; mężczyźni: >17 lat 30,0 – 400,0 ng/ml.
Całkowita i utajona zdolność wiązania żelaza
UIBC (ang. Unsaturated Iron Binding Capacity), czyli utajona zdolność wiązania żelaza umożliwia ocenę rezerw żelaza, a konkretnie – ile żelaza może jeszcze związać transferryna, która w momencie badanie nie jest zajęta jony żelaza.
Badanie UIBC można mierzyć bezpośrednio lub obliczać odejmując stężenie żelaza w surowicy krwi od wartości maksymalnej ilości żelaza potrzebnej do całkowitego zajęcia transferryny (TIBC – ang. Total Iron Binding Capacity). Również w druga stronę – oznaczenie UIBC wraz z wyznaczeniem stężenia żelaza w surowicy może posłużyć do wyznaczenia całkowitej zdolności wiązania żelaza (TIBC).
Prawidłowy stopień wysycenia miejsc wiążących żelazo w transferrynie wynosi ok. 30 – 38%. Pamiętajmy, że ilość zajętych cząsteczek transferryny zależy od zmian dostępności żelaza, jak i samego stężenia białka transportującego. W stanach niedoboru żelaza obserwuje się zwiększoną wartość UIBC – zwiększa się ilość transferryny, a spada jej wysycenie i odwrotnie – UIBC zmniejsza się w stanach nadmiaru żelaza czemu towarzyszy zwiększone wysycenie.
Należy jednak mieć także na uwadze fakt, że na stężenie transferryny wpływają także inne czynniki:
- stan zapalny (transferryna jest białkiem ostrej fazy)
- ciąża
- terapia estrogenowa
- choroby wątroby
- niedożywienie
Transferryna
Transferryna jest białkiem odpowiedzialnym za transport żelaza w krwi do tkanek, a następnie do wnętrza komórki. Tam żelazo jest magazynowane lub wykorzystywane do syntezy związków zawierających ten pierwiastek.
Oznaczenie transferryny w surowicy krwi umożliwia diagnostykę różnicową w kierunku anemii niedobarwliwej – z niedoboru żelaza.
Czas półtrwania transferryny w krwi wynosi 8-10 dni, a połowa puli znajduje się w przestrzeni pozanaczyniowej (m. in. w limfie czy płynie mózgowo-rdzeniowym). Stężenie transferryny zależy przede wszystkim od dostępności żelaza. W warunkach niedoboru żelaza obserwuje się wzrost stężenia, przy jednoczesnym zmniejszeniu stopnia wysycenia żelazem.
Po skutecznym leczeniu poziom transferryny stabilizuje się i wraca do normy. W warunkach nadmiaru żelaza poziom transferryny nie ulega zmianie, wzrasta natomiast wysycenie żelazem. Stan zapalny w tym przypadku powoduje obniżenie stężenia, podobnie jak występowanie chorób nowotworowych i alkoholizmu. Może to być także konsekwencją uszkodzenia nerek lub ciężkich poparzeń. Zakres wartości referencyjnych to zazwyczaj: 2,0 – 4,0 g/l.
Oprócz tych najbardziej typowych opisanych wcześniej badań poleca się także niekiedy wykonanie oznaczenia:
- witaminy B12 (dawniej test Schillinga)
- kwasu foliowego
- erytropoetyny
- stężenia innych witamin
- ocenę parametrów nerkowych i wątrobowych
- ocenę ewentualnych krwawień z przewodu pokarmowego (krew utajona w kale, USG jamy brzusznej, gastroskopia czy kolonoskopia)
- badania ginekologiczne
Anemia – podsumowanie
Diagnostyka anemii nie należy do bardzo skomplikowanych, gdy jej przyczyna jest prosta. Najczęściej mamy do czynienia z anemią z niedoboru żelaza. Przy łagodnych anemiach zazwyczaj próbuje się leczyć je modyfikacją diety.
Pamiętajmy, że nigdy nie leczymy złych wyników, a samego pacjenta. Dlatego tak ważne jest odpowiednie przeprowadzenie diagnostyki i starannie dobrane leczenie. Stąd zawsze poleca się konsultację ze specjalistą, odradzając w tym przypadku samoleczenie.
Bibliografia
- Chełstowska M, Warzocha K. Objawy kliniczne i zmiany laboratoryjne w diagnostyce różnicowej niedokrwistości. Onkol W Prakt Klin. 2006;2(3):105–16.
- Greer JP, Wintrobe MM: (red.): Wintrobe’s Clinical Hematology. Wolters Kluwer, Philadelphia 2009.
- Nowak W., Skotnicki A., Salamańczuk Z.: Podstawy diagnostyki laboratoryjnej..
- Hershko Ch, Skikne B: Pathogenesis and management of iron deficiency anemia. Sem. Hematol 2009; 46: 339-350.
- Matysiak M: Niedokrwistość z niedoboru żelaza – przyczyny, diagnostyka i leczenie. Ordynator Leków 2004; 4: 7-8, 3-6.
- Orkin SH, Fisher DE, Look AT et al.: Nathan and Oski’s Hematology of Infancy and Childhood. Saunders Elsevier. Philadelphia 2009.
- Blanc B, Finch C, Hallberg L, Herbert V. Nutritional anaemias. Report of a WHO scientific group. World Health Organ Tech Rep Ser. 1968;405:5–37.
- Packman CH: Hemolytic anemia due to warm autoantibodies. Blood Reviews 2008; 22: 17-32.
- Provan D, Singer CRJ, Baglin T, Lilleyman J: Hematologia kliniczna. Wyd Lek PZWL, Warszawa 2004.
- Sułek K: 1000 praktycznych pytań z hematologii. Wyd. 7 i pół Warszawa 1996.
- Sikorski T., Marcinowska-Suchowierska E.: Interpretacja wyników badań hematologicznych w praktyce lekarza rodzinnego. Post. Nauk Med. 2007, 4: 112–118.
- Sułek K, Wąsak-Szulkowska E: Hematologia w praktyce. Wyd. Lek PZWL, Warszawa 2007.
- Young NS, Gerson SL, High K: Clinical Hematology. Mosby Elsevier 2006.





![Fibromialgia — jak pomóc pacjentowi, któremu stale towarzyszy ból i zmęczenie? [podcast]](https://radioklinika.pl/wp-content/uploads/2023/07/Fibromialgia-choroba-reumatyczna-radioklinika-podcst-100x70.jpg)

